Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ~ Bagian 1

Hallo Sahabat semua, selamat datang kembali di Blog Administrasi Ngajar, seperti kita ketahui bersama sebentar lagi siswa SMA/MA akan menghadapi serangkaian Ujian Nasional yaitu Ujian Nasional Berbasis Komputer (UNBK). Untuk menghadapi Ujian Nasional tentu siswa harus mempersiapkan diri semaksimal mungkin. Salah satu tips sukses Ujian Nasional adalah mempelajari dan latihan soal UNBK dari tahun-tahun sebelumnya. Dengan itu pada kesempatan kali ini admin akan berbagi Soal UNBK Kimia SMA/MA Naskah Asli tahun 2019 Lengkap Beserta Pembahasannya.
Mata Pelajaran Kimia adalah salah satu mata pelajaran yang di ujikan pada Ujian Nasional UNBK, dan salah satu mata pelajaran yang menjadi perhatian khusus oleh siswa maupun guru. Mata pelajaran Kimia tidak cukup hanya sekedar menghafal materi, namun juga perlu banyak latihan soal, mencoba mengerjakan soal-soal Kimia sendiri ataupun Latihan Soal UNBK Kimia tahun sebelumnya.
Baca Juga :
- Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ~ Bagian 3
- Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ~ Bagian 4
Salah satu kunci sukses Ujian Nasional Kimia adalah dengan memperbanyak Latihan Soal Kimia baik di sekolah, di tempat bimbel, maupun di rumah. Untuk efisiensi waktu dalam menghadapi UNBK Kimia, kerjakan soal yang mudah, kemudian sedang, dan terakhir yang sukar. Baik langsung saja untuk pembahasan soal UN Kimia SMA Nomor 1-10.
Soal UNBK Kimia SMA dan Pembahasan Nomor 1
1. Perhatikan gambar model atom berikut!
Berikut beberapa pernyataan mengenai model atom:
- Tidak dapat menjelaskan susunan muatan positif dan negatif yang tersebar merata di seluruh bagian atom
- Atom merupakan bola pejal yang bermuatan positif dan di dalamnya tersebar elektron yang bermuatan negatif
- Tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik, pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang berelektron lebih banyak
- Atom merupakan partikel yang bersifat netral
Pasangan pernyataan yang tepat mengenai gambar model atom tersebut adalah ......
(1) dan (2)
(1) dan (3)
(1) dan (4)
(2) dan (4)
(3) dan (4)
Pembahasan Soal Nomor 1
Gambar pada soal ini mencirikan model atom Thomson.
Pernyataan yang tepat dengan model atom Thomson adalah (2) dan (4)
Jawaban : D
Soal UNBK Kimia SMA dan Pembahasan Nomor 2
2. Massa rata-rata satu atom unsur X adalah 3,82 × 10–23 gram, sedangkan massa satu atom karbon (C-12) adalah 1,992 ×10–23 gram. Massa atom relatif (Ar) unsur X adalah ......
Jawaban : A
Soal UNBK Kimia SMA dan Pembahasan Nomor 3
3. Perhatikan data lima notasi unsur (bukan lambang unsur sebenarnya) berikut!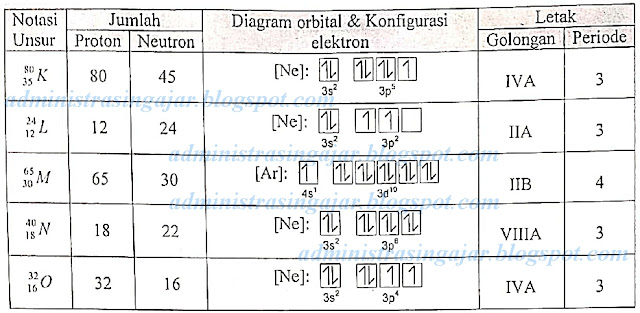
Data yang berhubungan dengan tepat ditunjukkan oleh notasi unsur.....
A. V
B. W
C. X
D. Y
E. Z
Jawaban : A
Soal UNBK Kimia SMA dan Pembahasan Nomor 4
4. Vanadium termasuk logam unsur transisi dengan notasi . Konfigurasi vanadium pada keadaan dasar adalah .....A. 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^3
B. 1s2 2s2 2p6 3s2 3p6 4s1 3d3
C. 1s2 2s2 2p6 3s2 3p5 4s2
D. 1s2 2s2 2p6 3s2 3p6 3d3 4s0
E. 1s2 2s2 2p6 3s2 3p6 3d7 4s2
Jawaban : A
Soal UNBK Kimia SMA dan Pembahasan Nomor 5
5. Asam sulfat merupakan salah satu bahan kimia yang banyak digunakan di laboratorium maupun industri. Pembuatan asam sulfat yang dilakukan melalui proses kontak, salah satu tahapannya membakar belerang murni di udara adar terbentuk gas SO2.Persamaan reaksinya:
S(s) + O2 (g) → SO2(g)
Berikut data hasil percobaan pembakaran belerang murni menghasilkan gas SO2.
Hukum dasar kimia yang mendasari wacana tersebut adalah ......
A. Hukum Lavoisier
B. Hukum Proust
C. Hukum Dalton
D. Hukum Gay Lussac
E. Hukum Avogadro
Pembahasan Soal Nomor 5.
Memang semua reaksi kimia selalu berlaku Hukum Kekekalan Massa (Hukum Lavoisier), tampak massa zat-zat sebelum dan sesudah reaksi tidak berubah, atau tetap. Untuk data pada setiap percobaan menghasilkan kelipatan tertentu untuk massa gas (32, 64, 128) hal ini menjadi dasar Hukum Perbandingan Tetap (Hukum Proust).
Jawaban : B
Soal UNBK Kimia SMA dan Pembahasan Nomor 6
6. Larutan asam klorida (HCl) pekat tersedia di laboratorium dengan konsentrasi 11,8 M. Jika Mr HCl = 36,5 dan massa jenisnya 1,18 g/mL, kadar asam klorida pekat adalah sebesar .....A. 1,00%
B. 3,65%
C. 7,10%
D. 10,00%
E. 36,50%
Pembahasan Soal Nomor 6.
Perhitungan massa HCl dalam 11,8 M larutan:
[HCl] = 11,8 M atau bila volumenya 1 liter maka jumlahnya 11,8 mol HCl.
11,8 mol HCl = 11,8 mol × 36,5 g/mol = 430,7 g
Perhitungan massa HCl berdasarkan massa jenis HCl.
Dengan massa jenis HCl 1,18 g/mL maka 1 liter = 1.180 g.
Kadar HCl = (430,7 g)/(1.180 g) × 100% = 36,50%
Jawaban : E
Soal UNBK Kimia SMA dan Pembahasan Nomor 7
7. Besi bereaksi dengan belerang membentuk besi (II) sulfida menurut persamaan reaksi:Fe(s) + S(s) → FeS(s)
Bila 28 gram besi bereaksi dengan 32 gram belerang, massa besi(II) sulfida yang terbentuk adalah sebanyak ...... (Ar =Fe = 56, S = 32)
A. 22 gram
B. 44 gram
C. 56 gram
D. 60 gram
E. 88 gram
Pembahasan Soal Nomor 7
Reaksi setara: Fe(s) + S(s) → FeS(s)
Perbandingan koefisien setara masing-masing zat adalah 1 : 1 : 1
n Fe = (28 g)/(56 g/mol)
n Fe = 0,5 mol
n S = (32 g)/(32 g/mol)
n S = 1 mol
Fe sebagai pereaksi pembatas, 0,5 mol Fe akan habis bereaksi dengan 0,5 mol S. S bersisa 0,5 mol. FeS yang terbentuk juga hanya 0,5 mol saja.
m FeS = n FeS × M FeS
m FeS = 0,5 mol × (56 + 32) g/mol
m FeS = 0,5 mol × 88 g/mol
m FeS = 44 g
Jawaban : B
Soal UNBK Kimia SMA dan Pembahasan Nomor 8
8. Hasil produksi asam sulfat lebih banyak menggunakan proses kontak dibanding dengan proses kamar timbal. Melalui proses kontak, kadar asam sulfat yang diperoleh 98%. Bila massa jenis asam sulfat pekat sebesar 1,8 g/mL, molaritasnya adalah ..... (Ar: H = 1, S = 32, O = 16)A. 13,57 M
B. 17,64 M
C. 18,00 M
D. 18,36 M
E. 21,51 M
Pembahasan Soal Nomor 8
Konversi satuan % massa menjadi Molar
Diketahui massa molar H2SO4 = (1×2)+32+(16×4) g/mol = 98 g/mol
Perhitungan massa H2SO4 setiap 1 L
m H2SO4 = kadar × massa jenis
m H2SO4 = 98% × 1,8 g/mL × 1000 mL
m H2SO4 = 1.764 g
n H2SO4 = (1.764 g)/(98 g/mol)
n H2SO4 = 18 mol
[H2SO4] = (18 mol)/(1 L)
[H2SO4] = 18 M
Jawaban : A
Soal UNBK Kimia SMA dan Pembahasan Nomor 9
9. Perhatikan tabel berikut!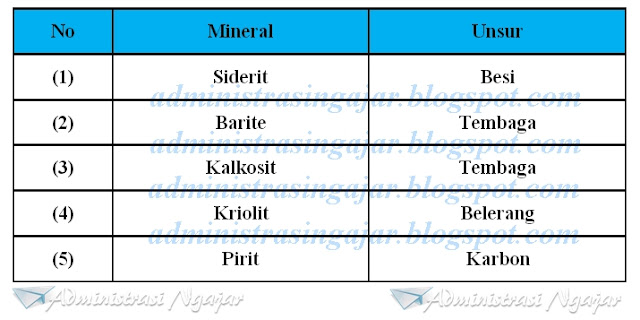
Pasangan data yang benar antara unsur dan mineralnya adalah nomor ......
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (5)
E. (4) dan (5)
Jawaban : C
Soal UNBK Kimia SMA dan Pembahasan Nomor 10
10. Gas klorin dapat dibuat melalui proses Down dengan reaksi:(–): Na+(l) + 1e– → Na(s)
(+): Cl–(l) → ½ Cl2(g) + 1e–
Perhatikan beberapa pernyataan berikut!
- Gas O2 dihasilkan di katode
- Logam Cu atau Ag dapat dijadikan sebagai anode
- Gas klorin dihasilkan di anode
- Sumber utama pembuatan gas tersebut adalah garam batu.
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan Soal Nomor 10
Katode (–): Na+(l) + 1e– → Na(s)
Anode (+): Cl–(l) → ½ Cl2(g) + 1e–
Di katode hanya dihasilkan logam Na
Di anode dihasilkan gas klorin
Logam yang digunakan sebagai anode syaratnya memiliki potensial reduksi standar yang lebih positif dibanding potensial reduksi standar dari Cl. Logam tersebut harus lebih sulit teroksidasi dibanding Cl, karena tujuannya adalah mengoksidasi Cl. Jadi Cu dan Ag tidak dapat dijadikan sebagai anode karena memiliki Eo reduksi lebih negatif, bila lebih negatif maka ia lebih mudah teroksidasi dibanding Cl.
Bila diperiksa pada tabel potensial reduksi dapat disusun reaksi oksidasi:
Cu → Cu2+ + 2e– Eo = –0,34
Cu → Cu+ + e– Eo = –0,52
Ag → Ag+ + e– Eo = –0,80
2Cl– → Cl2 + 2e– Eo = –1,36
Sumber utama pembuatan gas klorin adalah garam NaCl yang secara komersial akan digunakan garam batu.
Jawaban : E
Demikianlah Artikel yang Berjudul Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ~ Bagian 1
Terimakasih untuk sahabat semua yang sudah membaca artikel ini, Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ini dapat memberikan manfaat untuk para pembaca dimanapun berada.Jangan lupa juga Baca Soal dan Jawaban USBN SMA/MA bagian selanjutnya Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ~ Bagian 2. Soal dan Jawaban USBN SMA/MA Mata Pelajaran lainnya lengkap di Blog Administrasi Ngajar ini.
Artikel yang Anda baca berjudul Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ~ Bagian 1 dengan alamat link https://administrasingajar.blogspot.com/2019/09/soal-unbk-kimia-sma-dan-pembahasannya.html

Post a Comment for "Pembahasan Soal UNBK Kimia SMA/MA Tahun 2019 ~ Bagian 1"